Výskum na úrovni molekulovej patogenézy nádorov prináša stále nové poznatky o špecifických génoch, epigenetických a molekulových faktoroch a pomáha pochopiť procesy nádorovej patogenézy, čo prispieva k identifikácii molekulových cieľov pre liečbu nádorov.
Nádorové ochorenia sú celosvetovo hlavnou príčinou úmrtí a v roku 2020 si vyžiadali takmer 10 miliónov životov Najčastejšie ide o nádory prsníka, pľúc, hrubého čreva a konečníka a prostaty. Na Slovensku pribudne ročne približne 35-tisíc novodiagnostikovaných onkologických ochorení a sú dlhodobo 2. najčastejšou príčinou hospitalizácií. V posledných dekádach dochádza k veľkému pokroku v oblasti molekulárnej biológie a molekulárnej genetiky nádorov. Do klinickej praxe sa dostávajú nové vyšetrovacie postupy, ktoré sú založené na nových inovatívnych diagnostických metódach a princípoch. Pokroky na úrovni molekulovej patogenézy nádorov prinášajú neustále nové poznatky o špecifických génoch, epigenetických a molekulových faktoroch a pomáhajú pochopiť procesy nádorovej patogenézy, čo prispieva k identifikácii molekulových cieľov pre liečbu nádorov.
Cielená terapia predstavuje v ostatnej dekáde významný pokrok v liečbe viacerých malignít. Na rozdiel od tradičnej nešpecifickej liečby pôsobí na špecifické molekuly, ktoré bývajú v nádoroch vo zvýšenej expresii alebo sa vyskytujú v abnormálnom stave (1).
Molekulárne testovanie a jeho vývoj
Komplexné molekulárne profilovanie nádorov sa v posledných rokoch skúmalo pri rôznych typoch nádorov, čo viedlo k vývoju novej disciplíny, tzv. personalizovanej alebo presnej medicíny. Molekulárne profilovanie nádoru sa stáva štandardnou praxou pre väčšinu pacientov – predovšetkým s pokročilým štádiom ochorenia – a nahrádza používanú liečebnú paradigmu podávania štandardnej chemoterapie na základe orgánu pôvodu, histológie a štádia nádoru (2, 16). Pri výbere liečby sa teda pozornosť postupne sústreďuje skôr na biomarkery než na anatomické miesto pôvodu daného nádoru. Vďaka tejto zmene boli veľké skupiny pacientov, ktorých nádory nesú určitý molekulárny znak, úspešne liečené jediným cieleným liekom. (3).
Biomarkery môžeme definovať ako špecifické molekuly na povrchu alebo vo vnútri nádorových buniek, ktorých prítomnosť (expresia), nadmerná prítomnosť (overexpresia) alebo zmena štruktúry (mutácia) môže mať prognostický a/alebo prediktívny význam pre ďalší vývoj ochorenia a úspešnosť terapie.
Prognostický marker predpovedá prognózu ochorenia, ako sa bude ochorenie správať (agresivita, pravdepodobnosť metastázovania a i.), čo môže ovplyvniť celkovú liečebnú stratégiu, nepredpovedá však účinnosť konkrétneho lieku.
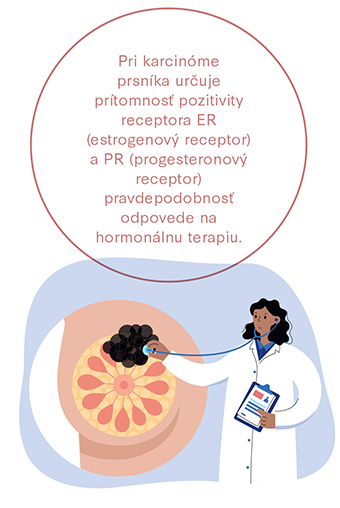
Prediktívny marker predpovedá (predikuje) pravdepodobnú účinnosť konkrétneho lieku. Napríklad pri karcinóme prsníka určuje prítomnosť pozitivity receptora ER (estrogenový receptor) a PR (progesteronový receptor) pravdepodobnosť odpovede na hormonálnu terapiu (2, 4).
Prvé príklady použitia prediktívnych markerov v onkológii sa týkali karcinómu prsníka. Analýza expresie estrogénového receptora (ER) v tkanivách karcinómu prsníka ukázala, že iba ER+ karcinómy profitujú z ovariektómie alebo z iných typov estrogénovej ablácie. V súčasnosti je stanovenie stavu estrogénových a progesterónových receptorov povinnou súčasťou diagnostiky karcinómu prsníka, ktorá riadi použitie endokrinnej terapie (5).
Objav amplifikácie a nadmernej expresie HER2 pri karcinóme prsníka viedol k vývoju niekoľkých terapií zameraných na HER2, pričom trastuzumab bol prvým liekom vo svojej kategórii. Podávanie trastuzumabu bolo od začiatku šité na mieru ženám, ktorých nádory vykazovali jasný dôkaz aktivácie génu HER2. Analýza stavu HER2 sa teraz rutinne využíva pri liečbe karcinómu prsníka a žalúdka (5, 6).
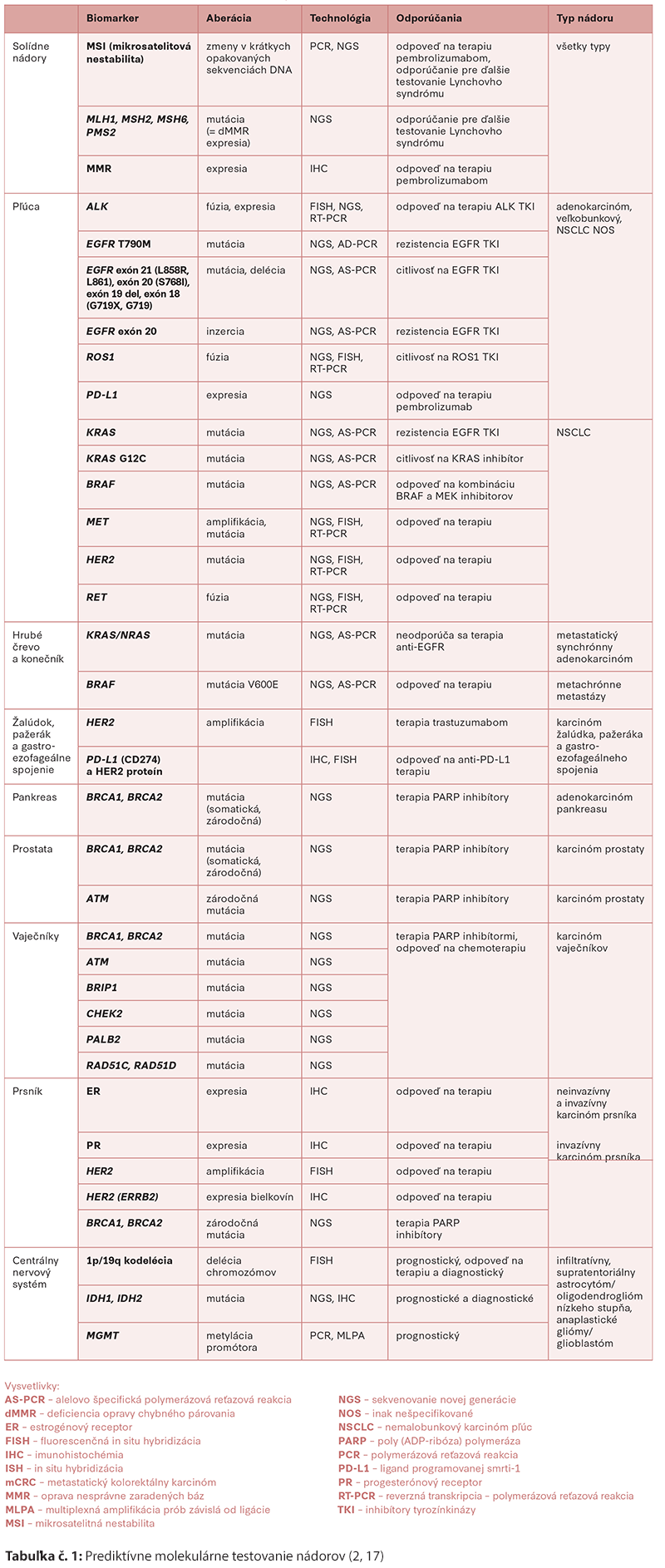
Cielená terapia vykazuje účinnosť v správnej podskupine pacientov. V Tabuľke č. 1 uvádzame príklady prediktívnych biomarkerov pre vybrané skupiny ochorení, ktoré možno použiť na manažment liečby podľa usmernení pre klinickú prax v onkológii (NCCN Guidelines), NCCN Biomarkers Compendium (NCCN.org) a odporúčaní a schválení FDA.
Molekulárne profilovanie nádorov a jeho metodológia
Molekulárne profilovanie sa týka analýzy DNA, RNA a/alebo proteínov v rámci nádoru jednotlivého pacienta v bunkách získaných z biopsie nádoru alebo prostredníctvom zachytenia nádorových buniek cirkulujúcich v krvnom riečisku. Termín „molekulárne profilovanie“ bol pôvodne aplikovaný na analýzu DNA, ale s pokrokom v technológii nadobudol širší význam a zahŕňa analýzy RNA a proteínov.

Pri diagnostike nádorov sa identifikujú rôzne typy alterácií/génových zmien, medzi hlavné radíme:
- Jednonukleotidové varianty (SNV), tiež známe ako bodové mutácie. SNV sú výsledkom substitúcie bázy na jednom nukleotide. Tieto môžu viesť k zmene aminokyselinovej sekvencie kódovaného proteínu (missense variant) alebo k predčasnému skráteniu proteínu (nonsense variant).
- Malé duplikácie po sebe idúcich nukleotidov, inzercie alebo delécie zahŕňajúce jeden alebo niekoľko nukleotidov alebo komplexnejšie mutácie zahŕňajúce súčasné delécie a inzercie jednej alebo niekoľkých báz (indely). Tieto typy mutácií môžu byť „in frame“, čo vedie k pridaniu alebo odčítaniu aminokyselín v proteíne, alebo môžu spôsobiť „frame shift“, čo zvyčajne vedie k predčasnému skráteniu proteínu.
- Zmeny počtu kópií exónu alebo génu. Zmeny počtu kópií exónu zahŕňajú veľké duplikácie alebo delécie zahŕňajúce celé exóny a ovplyvňujúce funkčné domény proteínu. Zmeny v počte kópií génu zahŕňajú amplifikácie alebo delécie celého génu.
- Štrukturálne varianty (SV) alebo veľké štrukturálne anomálie genetického materiálu vrátane translokácií alebo inverzií, ktoré sú výsledkom bodov zlomu medzi viacerými chromozómami alebo v rámci jedného chromozómu. Výsledkom sú často fúzne gény a súvisiace fúzne proteíny (14).
Najjednoduchšie molekulárne testy detegujú iba jeden typ mutácie/variantu v jednom géne, napríklad SNV. Príkladom takéhoto testovania je detekcia špecifickej substitúcie T za A na pozícii c.1799 génu BRAF, čo vedie k aminokyselinovej zámene kyseliny glutámovej za valín (p.V600E). Mutácia V600E sa bežne identifikuje pri melanóme. Naopak, najkomplexnejšie testy, tzv. testy pre komplexné genomické profilovanie nádoru, dokážu súčasne odhaliť všetky hlavné typy génových zmien vrátane substitúcií, duplikácií, inzercií, delécií, indelov, variácií počtu génových kópií a štrukturálnych variantov vrátane inverzií a translokácií. Pridanou hodnotou týchto testov je identifikácia tzv. imuno-onkomarkerov, mutačnej nálože nádoru (TMB) a mikrosatelitovej instability (MSI), ktoré predikujú odpoveď na imunoterapiu.
Molekulárne profilovanie nádoru sa vo všeobecnosti vykonáva z DNA extrahovanej zo vzoriek tkaniva stabilizovaného vo formalíne a zaliateho v parafínových blokoch (FFPE). Pred testovaním si vzorka tkaniva vyžaduje vyšetrenie patológom, aby sa potvrdila prítomnosť nádoru a určil sa obsah nádoru vo vzorke.
Typy molekulárnych testov
- Alelovo špecifická PCR
Cielená analýza na detekciu špecifických jednonukleotidových variantov (SNV). PCR v reálnom čase, ktorá využíva sadu 3 primerov vo dvoch kombináciách PCR reakcií, dva primery majú odlišnú sekvenciu na 3´ koncoch, jeden na detekciu wt (wild type) a druhý primer na detekciu mutantnej alely, reakcia neprebehne ak miesto na templátovej DNA nie je komplementárne k 3´ koncu primeru, pretože DNA polymeráza vyžaduje úplnú hybridizáciu primera na 3´ konci. Takto je možné rozlíšiť prítomnosť štandardnej (wildtype – wt) a mutantnej alely, respektíve SNV (7).
Dĺžka analýzy: 1 – 2 dni.
Výhody: Citlivosť – dokáže detegovať mutovanú DNA, ak je prítomná v množstve 1 – 5 %. Netreba žiadne dodatočné vybavenie.
Nevýhody: Cieľovo špecifická a nemôže detegovať iné mutácie, ktoré môžu byť prítomné v nádorovej DNA. - Sekvenovanie podľa Sangera
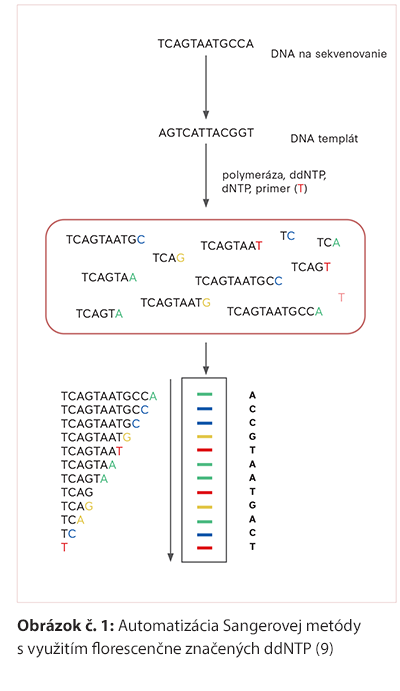
Využíva sa predovšetkým na identifikáciu neznámych mutácií vrátane SNV a malých duplikácií, inzercií, delécií a indelov. Sangerovo dideoxynukleotidové sekvenovanie sa typicky uskutočňuje na PCR produktoch. Sekvenačné primery hybridizujú s PCR produktom a predĺžujú sa pomocou DNA polymerázy, štyroch deoxynukleotidov (dNTP) a zmesi fluorescenčne značených dideoxynukleotidov (ddNTP). Každý zo štyroch ddNTP je označený iným fluorescenčným farbivom. Náhodné začlenenie značených ddNTP vedie k ukončeniu reťazcov v každom mieste pozdĺž sekvencie. Kapilárna elektroforéza oddeľuje vlákna podľa veľkosti a koncové nukleotidy sa merajú pomocou fluorescenčnej spektroskopie. V rámci Sangerovej metódy sú v súčasnosti používané automatizované zariadenia, využívajúce na separáciu a zoradenie fragmentov DNA kapilárnu elektroforézu, veľmi často v paralelnom usporiadaní (8). Jednotlivé modifikácie umožnili spojiť replikáciu a následnú elektroforézu do jednej reakcie, namiesto pôvodných štyroch, čo prispelo k zrýchleniu a zlacneniu celého procesu sekvenovania (Obrázok č. 1). Emitované fluorofory sú v priebehu elektroforézy snímané a následne analyzované a vyhodnotené v podobe chromatogramu.
Dĺžka analýzy: 2 – 3 dni.
Výhody: Je možné detegovať rôzne neznáme mutácie. Môže sa využiť aj na detekciu génových fúzií, ak sa zo vzorky najskôr extrahuje RNA z fúzneho transkriptu. Netreba žiadne dodatočné vybavenie.
Nevýhody: Zdĺhavé pracovné workflow. Vyžaduje prítomnosť mutantnej DNA na úrovni 20 – 25 %. Nie je možné stanoviť zmeny v počte kópií génu. - Multiplexná amplifikácia prób závislá od ligácie – MLPA (multiplex ligation-dependent probe amplification)
Používa sa na určenie počtu kópií exónu a génu na úrovni DNA alebo mRNA. V závislosti od experimentálneho dizajnu môže detegovať aj SNV. Multiplexná amplifikácia prób závislá od ligácie je variácia multiplexnej PCR umožňujúca namnoženie viacerých úsekov DNA za použitia iba jedného páru primerov, avšak s podmienkou vytvorenia sekvenčne špecifickej próby ligáciou sekvenčne špecifických oligonukleotidov. MLPA môže byť použitá na analýzu CpG-metylácie (MS-MLPA, Methylation-Specific MLPA). MS-MLPA je určená na detekciu aberantných metylácií imprintovaných oblastí, ako aj na detekciu metylačných zmien CpG ostrovčekov lokalizovaných blízko promótora. Rozdiel oproti štandardnej MLPA spočíva v použití metylačne senzitívneho restrikčného enzýmu HhaI, ktorý štiepi MS-MLPA próby hybridizované k nemetylovanej sekvencii. Amplifikované produkty sa detegujú a analyzujú kapilárnou elektroforézou (7).
Dĺžka analýzy: 2 – 3 dni.
Výhody: Rýchlosť a schopnosť detekovať viacero mutácií súčasne. Netreba žiadne dodatočné vybavenie.
Nevýhody: Na detekciu variantu exónu alebo kópie génu sa vyžaduje prítomnosť mutantnej DNA v úrovniach
20 – 40 %. Cielené SNV aj varianty počtu exónových a génových kópií sú špecifické a iné mutácie v nádorovej DNA nemožno detegovať. Próby nie sú dostupné pre všetky gény. - Fluorescenčná in situ hybridizácia – FISH
Využíva sa na identifikáciu cielených zmien počtu kópií génu (delécie, amplifikácie) a cielené štrukturálne varianty (translokácie a fúzie). In situ hybridizácia (ISH) lokalizuje a určuje špecifickú sekvenciu DNA alebo RNA v tkanivovom reze (in situ) alebo v cirkulujúcich nádorových bunkách pomocou značenej komplementárnej DNA, RNA alebo pomocou sondy modifikovaného vlákna nukleovej kyseliny. Génové fúzie sa bežne vyskytujú pri epiteliálnych nádoroch ako výsledok genómových preskupení alebo abnormálneho spracovania mRNA. Techniky ISH zahŕňajú chromogénnu in situ hybridizáciu (CISH) a fluorescenčnú in situ hybridizáciu (FISH). Fluorescenčné sondy sa používajú na lokalizáciu požadovaných génov alebo sekvencií na jednom alebo viacerých chromozómoch. Na vizualizáciu sa používa fluorescenčná mikroskopia.
Dĺžka analýzy: 2 – 3 dni.
Výhody: Ľahko deteguje zmeny počtu kópií génu a cielené štrukturálne varianty, ktoré nie sú tak ľahko detekovateľné inými metódami.
Nevýhody: Vyžaduje tkanivo zaliate parafínom na nezafarbených sklíčkach, nedokáže odhaliť väčšinu typov mutácií vyskytujúcich sa v novotvaroch solídnych nádorov (14). - Sekvenovanie novej generácie (NGS – next generation sequencing)
Metóda sekvenovania novej generácie (NGS) využíva princípy sekvenovania, ktoré kombinujú techniky vyvinuté v Sangerovom sekvenovaní. Umožňuje paralelné sekvenovanie miliónov fragmentov DNA v jednej analýze. Proces NGS sekvenácie pozostáva zo 4 hlavných krokov. Príprava knižnice – mechanická/enzymatická fragmentácia vlákien DNA (150 – 500 bp) a následné priradenie adaptérov (krátka molekula DNA o presnej sekvencii) k jednotlivým fragmentom DNA. Tvorba klastrov – prichytenie jednovláknových DNA fragmentov pomocou adaptérových sekvencií na sklenenú platničku, tzv. flow cell (Illumina) alebo na magnetické nanoguličky (Ion Torrent) a následná amplifikácia jednotlivých fragmentov – bridge amplifikácia (Illumina) alebo emulzná emPCR (Ion Torrent), ktorej výsledkom je mnoho kópií fragmentu DNA (klaster). Sekvenovanie – priradenie jednotlivých fluorescenčne značených báz k templátu a ich súčasná detekcia – SBS technológia (sequencing by synthesis). Analýza dát zahŕňa 3 stupne. Primárna analýza dát prebieha automaticky v samotnom sekvenačnom systéme a pozostáva zo zobrazovania signálov, ich intenzity, base calling a určenia skóre kvality. Sekundárna analýza dát môže prebiehať v samotnom systéme alebo na vzdialenom serveri. Zahŕňa alignment a detekciu variantov. Terciárna analýza obnáša výslednú interpretáciu variantov (10, 12, 15). (Obrázok č. 2)
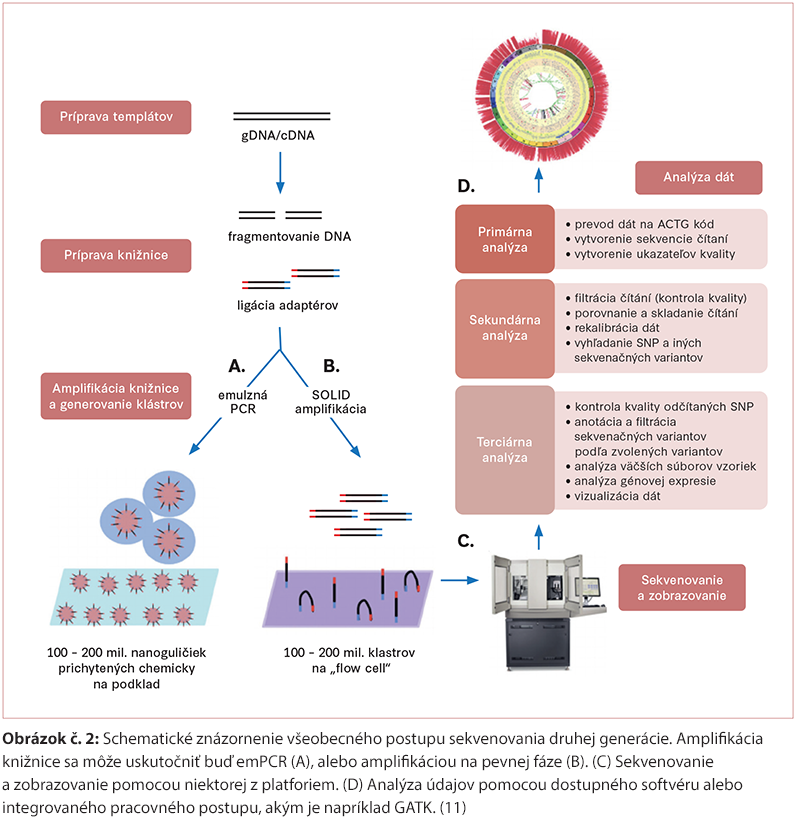
Z hľadiska tzv. šírky pokrytia (breadth of coverage) alebo percenta pokrytia genómu sekvenačnou reakciou delíme základné aplikácie NGS na:
- cielené (hotspot) sekvenovanie, respektíve panelové sekvenvanie,
- celoexómové sekvenovanie (WES – whole exome sequencing),
- celogenómové sekvenovanie (WGS – whole genome sequencing).

Sekvenovanie novej generácie – panelové sekvenovanie
Využitie: Substitúcie, duplikácie, inzercie, delécie a indely, zmeny počtu kópií a vybrané translokácie.
Dĺžka analýzy: Niekoľko dní až týždňov, v závislosti od zložitosti testu.
Výhody: V porovnaní s inými metódami NGS môžu byť tieto panely lacnejšie a menej časovo nákladné, pretože majú obmedzenejší rozsah. Cielenie na konkrétne gény a varianty (hotspoty) umožňuje ich jednoduchú klinickú interpretáciu.
Nevýhody: Hlavnou nevýhodou je nízka šírka pokrytia daná počtom sekvenovaných génov, ktorá môže viesť k nezachyteniu potenciálne klinicky významných variantov.
Sekvenovanie novej generácie – celoexómové sekvenovanie
Využitie: Substitúcie, duplikácie, inzercie, delécie a zmeny počtu kópií.
Dĺžka analýzy: Niekoľko dní až týždňov.
Výhody: Väčšina patogénnych variantov (85 %) leží v kódujúcich častiach genómu. Funkčné dopady takýchto variantov sú lepšie interpretovateľné.
Nevýhody: Neumožňuje identifikáciu variantov v nekódujúcich oblastiach. Problém s náhodnými, potenciálne rizikovými nálezmi.
Sekvenovanie novej generácie – celogenómové sekvenovanie
Využitie: Určenie kompletnej genómovej sekvencie DNA.
Dĺžka analýzy: Niekoľko dní až týždňov, v závislosti od platformy NGS a metód analýzy.
Výhody: Poskytuje sekvencie kódujúcich aj nekódujúcich oblastí genómu a podáva najkomplexnejšiu charakteristiku genómovej DNA.
Nevýhody: Veľké množstvo získaných dát kladie vysoké nároky na ich interpretáciu. Finančná a časová náročnosť analýzy (2, 13, 14).
Záver
V súčasnosti sa pre účely personalizovanej onkológie najviac využíva cielené (hotspot) sekvenovanie, tzv. panelové sekvenovanie. Takýto prístup umožňuje zadefinovať panel v rozpätí desiatok až stoviek génov, ktorý zahŕňa gény obsiahnuté v kľúčových odporúčaniach (guidelines) pre nádorové ochorenia a v klinických štúdiách. S narastajúcim počtom génov zaradených do panelu narastá aj pravdepodobnosť záchytu klinicky relevantných mutácií. Na druhej strane, komplexné genomické profilovanie pomocou celogenómového sekvenovania (WGS) alebo celoexómového sekvenovanie (WES) môže pokryť všetky potenciálne klinicky relevantné genómové varianty.
Zavedenie masívneho paralelného sekvenovania do rutinnej diagnostiky prináša možnosť rýchlejšej diagnostiky onkologických ochorení, manažmentu liečebných nákladov a aplikácie personalizovaného prístupu v onkológii.
Literatúra
- Mladosievičová B a kol. Molekulové mechanizmy patogenézy nádorov, SAP, Bratislava 2011, 123 s
- El-Deiry, W. S., Goldberg, R. M.; Lenz H-J., Shields, A. F., Gibney, G. T. et al. The current state of molecular testing in the treatment of patients with solid tumors, 2019. Online. CA: A Cancer Journal for Clinicians. 2019, roč. 69, č. 4, s. 305 – 343. ISSN 0007-9235. Dostupné z: https://doi.org/10.3322/caac.21560. [cit. 2023-10-28]
- Gambardella, V., Tarazona, N., Cejalvo, J. M., Lombardi, P., Huerta, M. et al. Personalized Medicine: Recent Progress in Cancer Therapy. Online. Cancers. 2020, roč. 12, č. 4. ISSN 2072-6694. Dostupné z: https://doi.org/10.3390/cancers12041009. [cit. 2023-10-29]
- Thenrajan, T., Alwarappan, S., Wilson, J. Molecular Diagnosis and Cancer Prognosis-A Concise Review. Online. Diagnostics. 2023, roč. 13, č. 4. ISSN 2075-4418. Dostupné z: https://doi.org/10.3390/diagnostics13040766. [cit. 2023-10-28]
- Sokolenko, A. P., Imyanitov, E. N. Molecular Diagnostics in Clinical Oncology. Online. Frontiers in Molecular Biosciences. 2018, roč. 5. ISSN 2296-889X. Dostupné z: https://doi.org/10.3389/fmolb.2018.00076. [cit. 2023-10-29]
- Bartley, A. N., Washington, M. K., Colasacco, C., Ventura, Ch. B., Ismaila, N. et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. Online. Journal of Clinical Oncology. 2017, roč. 35, č. 4, s. 446 – 464. ISSN 0732-183X. Dostupné z: https://doi.org/10.1200/JCO.2016.69.4836. [cit. 2023-10-28]
- Pastoráková, A., Petrovič, R. Molekulárne metódy aktuálne používané v klinickej genetike, 2016 Univerzita Komenského v Bratislave, Lekárska fakulta, ISBN 978-80-223-4231-5
- Kamps R. et al. Next-Generation Sequencing in Oncology: Genetic Diagnosis, Risk Prediction and Cancer Classification. International Journal of Molecular Sciences [online]. 2017, 18(2) [cit. 2021-12-05]. ISSN 1422-0067. Dostupné z: doi:10.3390/ijms18020308
- Zdroj z internetu: https://atdbio.com/nucleic-acids-book/Next-generation-sequencing#Applications-of-Next-generation-sequencing [online]
- Metzker ML. Sequencing technologies — the next generation. Nature Reviews Genetics [online]. 2010, 11(1), 31 – 46 [cit. 2021-12-05]. ISSN 1471-0056. Dostupné z: doi:10.1038/nrg2626
- Bahassi E. et al. Next-generation sequencing technologies: breaking the sound barrier of human genetics. Mutagenesis [online]. 2014, 29(5), 303 – 310 [cit. 2021-12-05]. ISSN 0267-8357. Dostupné z: doi:10.1093/mutage/geu031
- Zdroj z internetu: https://biopedia.sk/molekularna-biologia/sekvenovanie-novej-generacie [online]
- prof. RNDr. Ondřej Slabý, Ph.D. Technologie genomového sekvenování pro účely precizní onkologie, Datum publikace: 28. 5. 2019
- Zdroj z internetu: https://www.mycancergenome.org/content/page/molecular-testing/ [online]
- Zdroj z internetu: https://www.genetica.sk/next-generation-sequencing [online]
- Kodet O., Lacina L. Základy molekulární biologie nádorů pro praxi. Čes-slov Derm, 92, 2017, No. 6, p. 247 – 262
- Zdroj z internetu: https://www.nccn.org/guidelines/category_1 [online]